EV-A71是1969年首次从美国加利福尼亚州的脑炎患儿粪便标本中分离到的,此后在世界范围内出现多次 EV-A71感染导致的手足口病流行。
1.生物学性状 EV-A71的生物学性状与其他肠道病毒相似,病毒颗粒为典型的小 RNA 病毒颗粒。在体外细胞培养时,EV-A71存在空心(empty,E)和实心(full,F)两种病毒颗粒,E颗粒为空心的缺陷结构,F颗粒是实心的成熟病毒颗粒。
EV-A71基因组与其他肠道病毒相似,根据病毒衣壳蛋白 VP1核苷酸序列的差异,可将EV-A71分为7个基因型(A~G),各型间至少存在15%核苷酸序列的差异;B和C型各自包括BO~B7和C1~C6亚型。A型多流行于美国,B型和C型呈全球分布,我国传播较为广泛的是C4型。
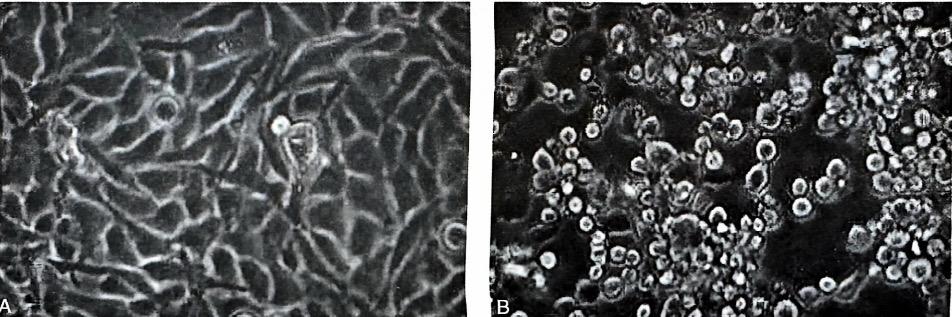
培养EV-A71的细胞有RD细胞(人横纹肌肉瘤细胞)和Vero 细胞(非洲绿猴肾细胞)。病毒液接种RD细胞三天后,可逐渐观察到细胞变圆、胞质内颗粒增加、细胞从培养器皿上脱落等细胞病变现象。也可用敏感的实验动物进行病毒分离,常用1~3日龄的ICR乳鼠。EV-A71经腹腔途径感染乳鼠后,小鼠出现精神萎靡、肢体麻痹瘫痪、消瘦、死亡等现象,并可在病变最明显的脑组织中分离到病毒或检测到病毒 RNA。
目前已经报道的 EV-A71受体主要有人清道夫受体B2(scavenger receptor B2,SCAR-B2)P选择素糖蛋白配体1(P-gelecting glycoprotein ligand-1,PSGL-1,CD162)以及一些辅助受体,如 Anx2、HSP90、波形蛋白(vimentin),硫酸乙酰肝素蛋白聚糖和唾液酸多聚糖等。病毒受体广泛分布于白细胞、内皮细胞和神经细胞表面,因此EV-A71感染常累及中枢神经系统,且感染具有较高的重症率和病死率。
EV-A71抵抗力较强,能够耐受胃酸、胆汁,在室温下可存活数天。能够抵抗乙醚和氯仿等有机溶剂,还能够抵抗70%乙醇和5%甲酚皂溶液等常用的消毒剂;但对 56℃以上的高温、氯化消毒、甲醛和紫外线的抵抗力较差。
2.致病性 EV-A71的传染源是病人和无症状带毒者,经粪-口途径、呼吸道飞沫或直接接触传播。EV-A71可引起手足口病、疱疹性咽峡炎和无菌性脑膜炎等多种疾病,严重感染者可引起死亡。
病毒侵人人体后,在淋巴组织中增殖后人血,形成第一次病毒血症。病毒经血循环带到器官和组织中大量繁殖,再次人血形成第二次病毒血症。病毒在侵人部位大量繁殖可引起严重病变。
EV-A71感染者多表现为隐性感染,有症状的显性感染者多为6个月~5岁的婴幼儿。病人表现为发热,1~2天后在手、足、唇和口腔黏膜、臀部等出现皮疹或疱疹,即手足口病。手足口病是一种急性传染病,我国于1981年首次报道此病,1995年分离到EV-A71,是我国近年来手足口病的主要病原体,并呈持续流行状态,已经成为我国严重的公共卫生问题之一,2008年5月被列人法定丙类传染病。EV-A71也可引起疱疹性咽峡炎。少数病人可并发无菌性脑膜炎、脑干脑炎、急性弛缓性麻痹和心肌炎等,病后可出现一过性或终生后遗症。重症患儿病情进展快,可因心肺衰竭及急性呼吸道水肿而死亡。
手足口病可由20多种肠道病毒引起,包括柯萨奇病毒、埃可病毒和新型肠道病毒等,但以EV-A71和CVA16常见。手足口病是全球性传染病,已有的流行病学资料显示,手足口病的重症、危重症和死亡病例多由EV-A71感染引起,其中神经源性肺水肿(neurogenic pulmonary edema,NPE)是EV-A71感染所致的重要并发症和病人死亡的主要原因。
3.免疫性 固有免疫和适应性免疫中的体液免疫和细胞免疫均参与抗EV-A71免疫,≤6个月的婴儿因为从母亲获得有IgG型抗体,对 EV-A71感染具有一定免疫力。机体被EV-A71感染后,可以诱生抗VP1的特异性中和抗体。
4.微生物学检查法 EV-A71的微生物学检查方法主要有以下三类。
(1)特异性抗体检测:检测抗EV-A71的IgM 型抗体,可对 EV-A71的近期感染进行诊断。对已知病毒血清型的感染者,可采集发病早期和恢复期双份血清标本,若血清抗体效价有4倍或以上增长,具有诊断意义。
(2)病毒核酸检测:采用 RT-PCR等分子生物学方法,检测标本中的EV-A71的基因组 RNA,具有快速、简单、敏感性高等优点,是目前比较常用的检测方法。
(3)病毒分离培养和鉴定:采集病人粪便或疱疹液标本,接种易感细胞培养后进行病毒学鉴定。EV-A71的分离培养具有费力、耗时长、不能达到早期诊断要求等缺点,故临床诊断不常用。
5.防治原则 目前我国已有针对EV-A71疫苗,可用于预防 EV-A71感染所致手足口病。针对手足口病尚无特效的抗病毒药物和特异性治疗手段,一般采用常规的抗病毒和对症处理的方法。多数病人一周左右痊愈,但重症病人需住院治疗,而且要密切注意病情变化,才能减少患儿的死亡。